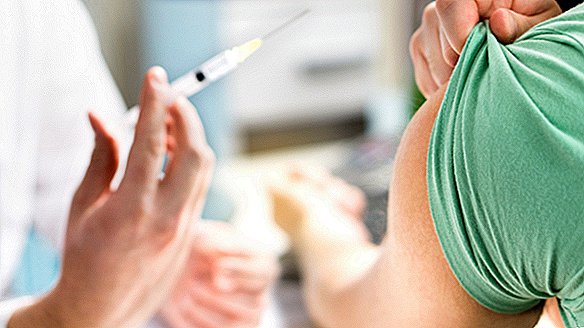
Um voluntário saudável em Seattle é a primeira pessoa nos EUA a receber uma dose de uma vacina experimental contra o coronavírus como parte de um novo ensaio clínico, anunciaram autoridades de saúde do governo hoje (16 de março).
Nas próximas seis semanas, os pesquisadores planejam inscrever 45 participantes no estudo, que testará a segurança da vacina e sua capacidade de induzir uma resposta imune nos voluntários. O julgamento será realizado no Kaiser Permanente Washington Health Research Institute (KPWHRI), em Seattle.
O Instituto Nacional de Alergia e Doenças Infecciosas (NIAID) permitiu que a nova vacina fosse acelerada em ensaios clínicos sem testes completos em modelos animais, o que geralmente é um pré-requisito estrito para testes em humanos. Embora fazer o salto para testes em humanos possa levar a vacina ao mercado mais rapidamente, este é apenas o primeiro passo.
Novos medicamentos devem passar por três fases iterativas de ensaios clínicos antes de serem considerados seguros e eficazes para uso generalizado. Supondo que os testes iniciais vão bem, pode levar de 12 a 18 meses para que qualquer vacina esteja pronta para uso público, disse o diretor do NIAID, Dr. Anthony Fauci, ao Comitê de Supervisão e Reforma da Câmara em 12 de março.
"Encontrar uma vacina segura e eficaz para prevenir a infecção pelo SARS-CoV-2 é uma prioridade urgente da saúde pública", disse Fauci em uma declaração do NIAID, publicada em 16 de março. "Este estudo da Fase 1, lançado em velocidade recorde, é um primeiro importante passo em direção a atingir esse objetivo ".
A nova vacina é uma colaboração entre os cientistas do NIAID e a empresa de biotecnologia Moderna Inc., com sede em Cambridge, Massachusetts.
Notícias e ciência do coronavírus
-Coronavírus nos EUA: mapa e casos
-Quais são os sintomas?-Quão mortal é o novo coronavírus?-Quanto tempo dura o vírus nas superfícies?-Existe uma cura para o COVID-19?-Como ele se compara à gripe sazonal?-Como o coronavírus se espalha?-As pessoas podem espalhar o coronavírus depois que se recuperam?
O que é um teste de "Fase 1"?
O estudo lançado hoje é conhecido como "ensaio clínico de Fase 1", o que significa que seu principal objetivo é fornecer informações sobre como a vacina interage com um corpo humano saudável, de acordo com a Food and Drug Administration (FDA) dos EUA.
Os estudos de fase 1 examinam um pequeno grupo de pessoas, geralmente entre 20 e 80 indivíduos, que recebem doses diferentes de um tratamento experimental. Ao longo de vários meses, os pesquisadores monitoram como cada voluntário metaboliza o tratamento e quais efeitos colaterais comuns surgem em resposta a diferentes doses. Os 45 voluntários do novo estudo receberão doses variadas da nova vacina, chamada mRNA-1273, e serão monitorados por um período de 14 meses. Os voluntários receberão duas injeções da vacina na parte superior do braço, com um intervalo de 28 dias entre as doses.
O primeiro participante receberá a dose mais baixa da vacina, com 25 microgramas (mcg) por injeção, de acordo com a declaração do NIAID. Três outros receberão a mesma dose inicial, e outros quatro receberão uma dose de 100 mcg da vacina e serão cuidadosamente avaliados antes que os voluntários recebam a segunda dose. Se as reações dos participantes às doses baixas forem aceitáveis, um terceiro grupo de participantes receberá 250 mcg da vacina por injeção.
Além de monitorar os efeitos colaterais, os pesquisadores testarão se a vacina desencadeia uma resposta imune analisando o sangue dos voluntários em busca de anticorpos, de acordo com o ClinicalTrials.gov.
Se a vacina funcionar como planejado, o sistema imunológico deve gerar anticorpos que se apoderam de uma proteína característica encontrada na superfície do novo coronavírus SARS-CoV-2, de acordo com um relatório da Kaiser Permanente, a empresa de saúde que conduz o teste. Em vez de introduzir um vírus morto ou enfraquecido no organismo para provocar essa reação, como as vacinas convencionais, a vacina instrui as células a construir a proteína viral usando uma molécula chamada RNA mensageiro (mRNA). Uma vez utilizado pelo organismo, o RNAm deve quebrar e ser eliminado, deixando apenas para trás os anticorpos protetores.
Próximos passos
Os estudos de fase 2 normalmente examinam várias centenas de pessoas e monitoram os participantes por períodos de vários meses a dois anos. Primeiramente, os ensaios da Fase 2 servem como uma medida secundária de segurança e ajudam os pesquisadores a refinar a dosagem de um medicamento específico. Nesta fase, os pesquisadores selecionam participantes com características, como idade e saúde física, que correspondem às pessoas para as quais a vacina está sendo desenvolvida. (Por exemplo, embora qualquer pessoa possa contrair o COVID-19, pessoas com idade avançada e pessoas com condições crônicas têm maior probabilidade de desenvolver sintomas graves, portanto, isso pode ser considerado nos ensaios da Fase 2.)
Os ensaios da fase 3 normalmente seguem de 300 a 3.000 voluntários ao longo de um a quatro anos, de acordo com a FDA. Com um grupo maior de pessoas, os pesquisadores podem observar os efeitos colaterais incomuns da droga e, prolongando o período do estudo, podem detectar efeitos colaterais de longo prazo à medida que surgem. Os ensaios de fase 3 devem demonstrar que um determinado medicamento fornece os benefícios médicos a que se destina; se essa vacina contra o coronavírus passar no teste, o FDA poderá aprovar o medicamento para uso generalizado.
Esta vacina contra o coronavírus pode ou não atingir os testes da Fase 4 nos próximos anos, embora, até o momento, estudos limitados em camundongos tenham mostrado resultados promissores. Enquanto isso, grupos de pesquisa em todo o mundo continuarão desenvolvendo vacinas alternativas para combater a disseminação do COVID-19, de acordo com a Associated Press.